Was ist ein Validierungsplan und was sagt uns dieser?
Die Methodenvalidierung ist ein Bestätigungsprozess für die anzuwendenden analytischen Methoden, um ihre Eignung für den beabsichtigten Gebrauch zu bewerten. Validierungsergebnisse werden verwendet, um die Qualität, Zuverlässigkeit und Konsistenz von analytischen Methoden zu beurteilen. Analytische Methodenvalidierung ist daher integraler Bestandteil einer jeder guten analytischen Praxis und eine zwingende Voraussetzung für jede Methode, die in einem pharmazeutischen QC-Labor oder assoziierten Auftragslaboren zur Analyse von Arzneimitteln gemäß GMP-Bedingungen angewandt werden soll.
Als Faustregel gilt, dass analytische Methoden validiert oder revalidiert werden müssen
- vor ihrer Einführung in den Routineeinsatz für analytische Zwecke,
- für alle Änderungen der Methode nach ihrer initialen Validierung (z.B. Änderung der Pufferzusammensetzung, Änderung des Geräteprofils, Verwendung eines Standards eines anderen Herstellers etc.) und
- für jede Änderung, die außerhalb des ursprünglichen Einsatzzwecks der Methode liegt (z.B. Aufweitung der Anwendung, wenn z.B. nicht mehr nur ausschließlich Wirkstoff-Proben sondern auch vorherige Prozessintermediate analysiert werden sollen).
Jede Validierung besteht aus einem detaillierten Validierungsplan und einem Validierungsbericht. Der Validierungsplan ist ein Dokument, das den gesamten Plan für die Validierung sehr detailliert und eindeutig vorgibt, während der Validierungsbericht das Dokument ist, das die Übereinstimmung (sowie ggf. Abweichungen) der im Plan beschriebenen Durchführung durch die Darstellung der durchgeführten Experimente und die erhaltenen Ergebnisse abbildet und Auskunft über den Erfolg der Validierung gibt. In diesem Blogartikel werden wir ausführlich auf den Validierungsplan eingehen.
Der Inhalt eines Methodenvalidierungsplans
Das Schreiben eines Validierungsplans erfordert eine enorme Detailgenauigkeit, um u.a. die Entwicklung eines realistischen und ausgewogenen Zeitplans sicherzustellen. Ein guter Methodenvalidierungsplan sollte die folgenden Kapitel enthalten:
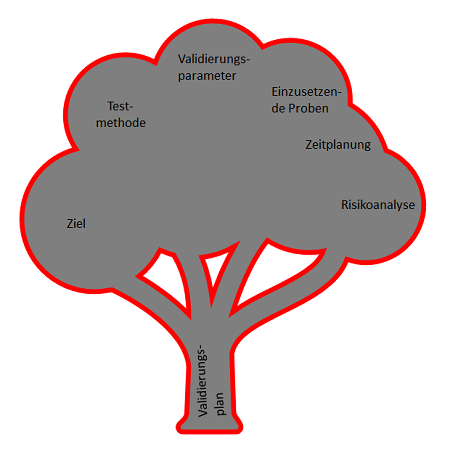
Das ist kein Muss, aber eine Empfehlung, wobei keine regulatorischen Vorgaben existieren, entsprechend kann natürlich auch die Reihenfolge geändert oder Kapitel können ergänzt, weggelassen oder umbenannt werden...
1. Ziel
Das Kapitel „Ziel des Plans“ ähnelt einer Einführung in das Dokument. Es enthält normalerweise einen Überblick über die Methodik. Es beginnt mit der Auflistung der beabsichtigten Verwendung der Methode, wie z.B. als Reinheitstest für z.B. die Freigabe von DS- / DP-Chargen. An diese Informationen kann sich eine kurze Beschreibung der zu verwendenden Methode oder Instrumente sowie das Training der durchführenden Analysten anschließen. Ein Validierungsplan muss die Parameter, die während der Validierung bestimmt werden sollen, und ihre Akzeptanzkriterien aufführen (dies kann beispielsweise durch eine Übersichtstabelle zu Beginn des Validierungsplans geschehen). Er sollte auch die Maßnahmen enthalten, die im Falle einer Abweichung vom ursprünglichen Plan zu ergreifen sind, oder einen Hinweis auf eine entsprechende Standardarbeitsanweisung (SOP), die sich mit dem Abweichungsmanagement befasst.
2. Testmethode
In diesem Kapitel wird ein detaillierterer Fokus auf die analytische Methode gelegt. Hier kann der Umfang der Methode ggf. zusammen mit Details zu den benötigten Geräten inklusive ggf. der zur Probenvorbereitung (Modell, Eigenschaften), funktionellen Details (Wellenlänge, pH), einzusetzenden Reagenzien, Auswertungsdetails (% Peakfläche, S/N-Verhältnis, ggf. mit Beispielchromatogramm) und Angaben zur Berechnung definiert und die genaue analytische Durchführung beschrieben werden. Dieser Abschnitt kann auch sehr kurz sein mit nur einem Hinweis auf die SOP der entsprechenden Testanweisung (--> Dokumentenreferenz) und vielleicht einer Erklärung des Test- / Reaktionsprinzips. Es versteht sich von selbst, dass vor dem Start einer Methodenvalidierung die zu validierende Methode natürlich vollständig beschrieben sein muss sowie die zu verwendenden Geräte qualifiziert / kalibriert sein müssen 😉
3. Zeitpläne und Verantwortlichkeiten
Hier wird ein realistischer Zeitplan für jeden Prozessschritt zusammen mit der jeweiligen zuständigen Abteilung oder Person aufgeführt. Da eine Validierung ein komplexer Prozess sein kann, der eine Vielzahl von Abteilungen umfassen kann (das können z.B. die QC- und QA-Abteilungen verschiedener Standorte im Falle von Co-Validierungen während eines Transfers sein), ist es wichtig, den Zeitplan aller beteiligten Abteilungen und Mitarbeiter zu berücksichtigen und die Zeitschienen entsprechend abzubilden.
4. Testproben und Referenzmaterialien
Wie es der Titel sagt, muss dieser Abschnitt detaillierte Informationen über die einzusetzenden Proben und Referenzmaterialien enthalten. Für beide, Referenzstandards und Proben, kann die Quelle (z.B. die zu verwendende Charge), der (Protein-) Gehalt, der Formulierungspuffer und die Matrixzusammensetzung klar angegeben werden. Zusätzlich können die Lagerungsbedingungen angegeben werden. Ferner kann zum Referenzstandard angegeben werden, um welche Art Referenzstandard (Primär- oder Sekundärstandard, Internationaler Standard, Referenzstandard der Ph. Eur., chemische Referenzsubstanz, biologische Referenzzubereitung) es sich handelt, ggf. mit Zertifikat und Spezifikation.
5. Validierungsparameter
Dieser Abschnitt ist von größter Bedeutung, da er die Details über alle Parameter wie Linearität, Richtigkeit, Präzision, Robustheit, Nachweis- und Bestimmungsgrenze (LOD / LOQ), Spezifität und Arbeitsbereich enthält, die bei der Validierung entsprechend der für den jeweiligen Methodentyp geltenden Anforderungen bestimmt werden müssen. Nicht jeder Parameter ist für jeden Methodentyp erforderlich. Details dazu gibt z.B. die Validierungsrichtlinie ICH Q2(R1). Zusammen mit der Auflistung enthält dieses Kapitel auch die Details zu jedem einzelnen Validierungsparameter. Zum Beispiel, wie die Präzision nachgewiesen werden soll. Hat dies nur mit der Wiederholpräzision und / oder der Laborpräzision oder auch mit der Vergleichspräzision zu erfolgen? Für jeden Parameter muss die Anzahl der Proben, die Anzahl der Analysten, ggf. die Dauer, die verwendeten Instrumente und auch die Konzentration der Probe / des Referenzstandards klar definiert sein. Von entscheidender Bedeutung ist in diesem Abschnitt die Festlegung der Akzeptanzkriterien für die Ergebnisse jedes zu untersuchenden Validierungsparameters. Mit ihnen lässt sich die der Erfolg der Validierung bewerten. Es ist selbstredend, dass Akzeptanzkriterien im Vorfeld definiert werden müssen, um eine objektive Entscheidungsgrundlage zu haben. Bei Betrachtung erhaltener Ergebnisse ohne zuvor definierte Akzeptanzkriterien bestünde die Gefahr, die erhaltenen Ergebnisse subjektiv als „schon passend“ zu beurteilen, was in keinster Weise zulässig ist. Es sollte auch angegeben werden, wie die Ergebnisse ausgewertet werden. In den meisten Fällen werden die erhaltenen Daten statistisch ausgewertet (Mittelwert, Standardabweichung, relative Standardabweichung, etc.), aber in einigen Fällen, wie LOD / LOQ, können die Ergebnisse auf verschiedene Arten wie z.B. mittels S/N-Verhältnis oder durch visuelle Beurteilung usw. erhalten werden. So kann eine kurze Erklärung und / oder z.B. ein Kapitel, das die Formeln zeigt, sehr nützlich sein (da z.B. auch Mittelwert und gewichteter Mittelwert nicht verwechselt werden sollten). Wegen der unterschiedlichen Zielrichtung der Methoden hat die ICH Q2(R1) den Umfang der anzuwendenden Validierungsparameter für jede Art von Methode klar definiert. Die Methoden sind in drei Kategorien eingeteilt: Identität, Reinheit, Assay (Gehalt und Wirksamkeit). Je nach Methodenkategorie sind unterschiedliche Parameter erforderlich, um die Eignung der Methode für ihren beabsichtigten Einsatzzweck nachzuweisen.
6. Risikoanalyse
In diesem Kapitel werden potenzielle Risiken aufgezeigt, die während der Durchführung der analytischen Methode auftreten können. Zum Beispiel eine schlechte Peakauflösung aufgrund erhöhter Säulentemperatur. Eine Risikoanalyse kann ein gutes Mittel sein, um die Experimente zu definieren, die für die Bewertung der Robustheit durchgeführt werden sollen (falls noch nicht während der Methodenentwicklung geschehen), da sie die kritischen Schritte der Methode herausarbeiten kann. Dieses Kapitel ist nicht zwingend erforderlich, aber gerade im Zusammenhang mit der Robustheit oft sinnvoll.
Die anderen Abschnitte können eine Beschreibung aller Berechnungen, gegebenenfalls ein Glossar, verwendete Referenzen, unterstützende Dokumente und Anhänge enthalten, die alle zusätzlichen Informationen enthalten können. Dabei sollten noch Vorgaben zu Art und Umfang des Validierungsberichtes sowie zur Ablage der Rohdaten gemacht werden.
Kurz gesagt, ein Validierungsplan muss so formuliert sein, dass er Antworten auf die folgenden Fragen enthält:
- Was ist die Identität des Analyten?
- Wie ist die Zusammensetzung und die Handhabung des Analyten, des/r Referenzstandard(s) und der Probenmatrix?
- Wie lange wird der Validierungsprozess dauern?
- Welche Art von Inventar und Instrumenten wird verwendet?
- Welches Personal ist involviert?
- Woher stammen die Proben und wie werden sie gelagert?
- Was ist der Umfang der Validierung?
- Welche Validierungsparameter werden untersucht?
- Was sind die definierten Kriterien für eine erfolgreiche Validierung?
- Wie werden die Ergebnisse ausgewertet?
- Falls ein Problem auftritt, wie wird damit umgegangen und wer ist verantwortlich?
Es ist auch wichtig zu beachten, dass jede Änderung / Abweichung extrem schwierig ist, sobald der Validierungsplan unterzeichnet ist. Daher ist es ratsam, die Methodenoptimierung beendet (und vielleicht eine Methodenqualifizierung durchgeführt) zu haben, bevor die Validierung geplant wird, um mögliche Kriterien zu bestimmen und sie einige Zeit vor Beginn der Validierungsaktivitäten im Validierungsplan festzulegen. Abschließend ist festzuhalten, dass die Analysten vor Start der Validierungstätigkeiten im genehmigten Validierungsplan zu schulen sind.
Beispiele
Einige Beispielvalidierungspläne finden Sie hier für eine Identitätsbestimmung, eine Reinheitsbestimmung und einen Assay. Des Weiteren gibt es ein Beispiel für einen übergeordneten Methodenvalidierungsplan, der die Parameter aller drei Methodentypen enthält und so die Auswahl der besten Formulierung ermöglicht.
