Was ist die ISO 13485?
Die ISO 13485, in Deutschland auch unter DIN EN ISO 13485 bekannt, stellt die Richtlinien für das Qualitätsmanagementsystem der Medizinproduktindustrie bereit. Diesem Umstand haben wir zu verdanken, dass man sich in Deutschland und weiten Teilen der EU darauf verlassen kann, bei medizinischen Produkten stets ausgezeichnete Qualität vorzufinden – völlig unabhängig davon, ob es sich um eine einfache, sterile Bandage oder ein hochtechnisches, aktives Implantat handelt. Schließlich sollte es beim Umgang mit Menschenleben keine Diskussionen hinsichtlich der Qualität der Produkte geben. Bei vielen Medizinprodukten ist eine Zertifizierung nach ISO 13485 daher gesetzlich vorgeschrieben.
Allgemeines zu ISO 13485
Bei der ISO 13485 handelt es sich um die ISO Norm, die die Erfordernisse an ein Qualitätsmanagementsystem für Produzenten von Medizinprodukten darstellt. Anders als zum Beispiel die ISO 9001 steht dabei allerdings nicht die kontinuierliche oder stetige Verbesserung im Fokus, sondern die Produktsicherheit.
Der korrekte Titel dabei lautet „Medizinprodukte – Qualitätsmanagementsysteme –Anforderungen für regulatorische Zwecke (ISO 13485:2016); Deutsche Fassung EN ISO 13485:2016“.
Ebenso wie auch bei anderen Normen kann die Zertifizierung eines solchen Managementsystems durch DAkks-akkreditierte Stellen erfolgen. Momentan gibt es in Deutschland knapp 60 durch die DAkks akkreditierte Zertifizierungsstellen.
Auch wenn die ISO 13485 in vielen Punkte ähnlich oder identisch mit der ISO 9001 ist, so ist eine ISO 9001 Zertifizierung kein Ersatz für eine fehlende ISO 13485 Zertifizierung. Und zwar aus folgenden Gründen:
- Die Anforderungen der ISO 13485 sind speziell für Managementsysteme im Bereich Medizinprodukte gemacht. D.h. manche Forderungen der ISO 9001 werden umformuliert und in einigen Bereichen macht die 13485 auch weitergehende Anforderungen auf.
- Teilweise ist eine ISO 13485 eine rechtliche Vorgabe, die halt nicht durch eine andere Norm ersetzt werden kann.
Prozessorientierter Ansatz
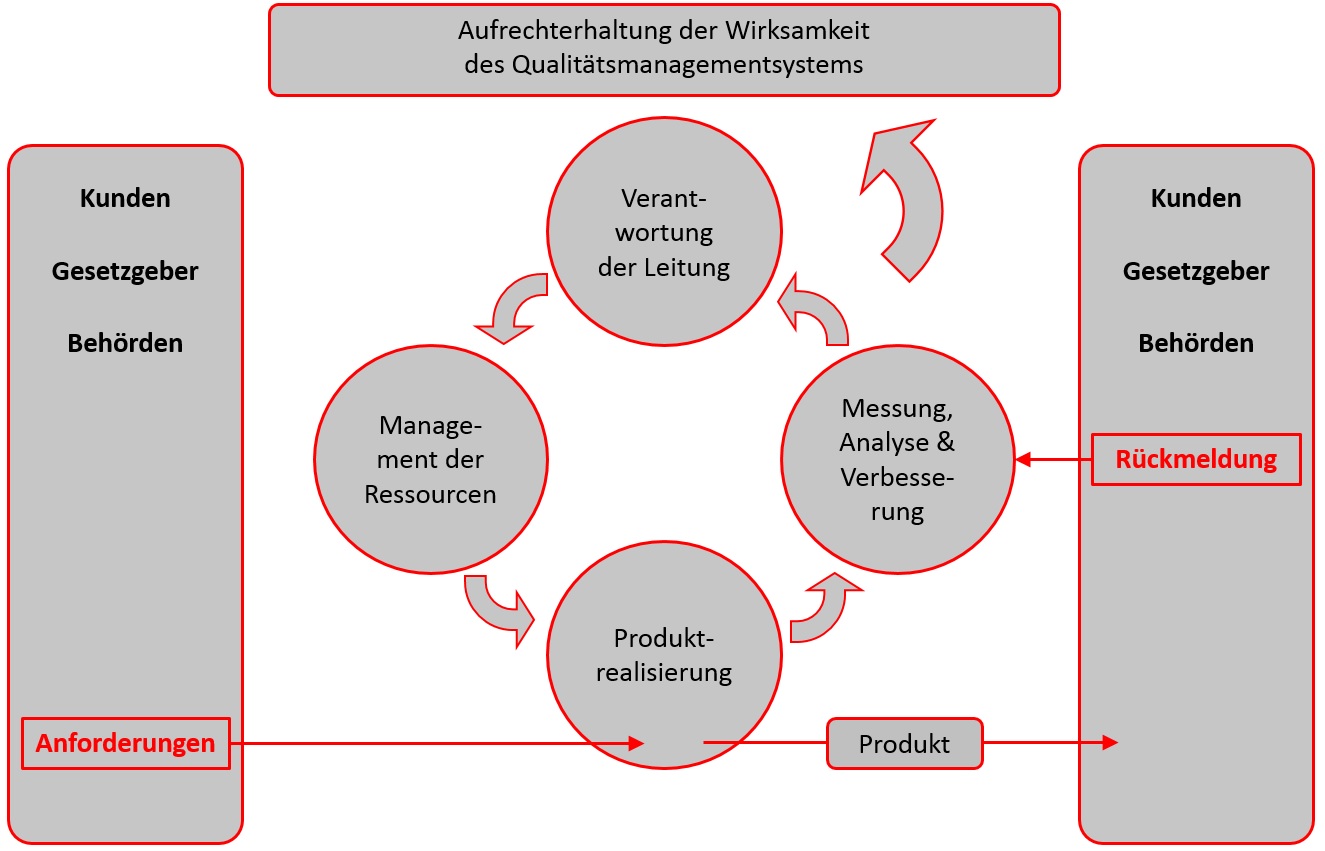
Schon in der Einleitung unter 0.3 Prozessorientierter Ansatz gibt die ISO 13485 die Marschrichtung aus, dass das Qualitätsmanagementsystem prozessorientiert aufgebaut sein muss. Dabei unterscheidet sich die ISO 13485 von der ISO 9001 in dem Punkt, dass es nicht um die relevanten interessierten Parteien und die stetige Verbesserung geht, sondern es vor allen Dingen um die Einhaltung von Anforderungen der Kunden und anderer regulatorischer Parteien (Gesetzgeber, Behörden) geht und der Fokus auf der Aufrechterhaltung der Wirksamkeit des Qualitätsmanagementsystems liegt.
ISO 13485 Handbuch
Ein weiterer Unterschied ist, dass explizit (auch in der ISO 13485:2016) ein Qualitätsmanagementhandbuch gefordert ist. Im Kapitel 4.2 Dokumentationsanforderungen wird diese Forderung aufgemacht und im Unterkapitel 4.2.2 Qualitätsmanagementhandbuch wird explizit gefordert, was das Handbuch mindestens enthalten muss:
Anwendungsbereich des Qualitätsmanagementsystems, inkl. Einzelheiten und Begründungen für alle Ausschlüsse oder Nicht-Anwendung
Dokumentierte Verfahren oder Verweise darauf
Beschreibung der Wechselwirkungen der Prozesse
In diesem Zusammenhang ebenfalls empfehlenswert ist, dass die ISO 13485 nicht von „dokumentierten Informationen“ spricht, sondern noch in Dokumente (Vorgaben) und Aufzeichnungen (Nachweise) unterscheidet.
Inhalte der Norm
Mit insgesamt 78 Seiten im DIN A4 Format ist die ISO 13485 mit Sicherheit kein Taschenbuch und auch die Lektüre dürfte sich etwas schwieriger als bei einem guten Roman gestalten. Aufgeteilt in 8 Kapiteln geht es nach dem Europäischen Vorwort, dem Vorwort und der Einleitung folgendermaßen weiter:
- Anwendungsbereich
- Normative Verweisungen
- Begriffe
- Qualitätsmanagementsystem
- Verantwortung der Leitung
- Management von Ressourcen
- Produktrealisierung
- Messung, Analyse und Verbesserung
Spätestens bei dieser Aufzählung wird klar, dass die Norm nicht nach der HLS (High Level Structure) aufgebaut ist.
Bei der Umsetzung der Normpunkte ist allerdings zu beachten, dass die ISO 13485 zwar Vorgaben macht, was umgesetzt werden muss, allerdings nicht, wie das getan werden muss. Besonders hervorzuheben ist dabei auch, dass schon in der Einleitung der Norm steht, dass die Qualitätsmanagementdokumentation von verschiedenen Faktoren beeinflusst wird, z.B.:
- Größe und Struktur der Organisation
- Bereitgestellte Produkte
- Angewendete Prozesse
- u.a.
In Anhängen der Norm werden weiterhin verschiedene Vergleiche aufgestellt, z.B. zwischen:
- ISO 13485:2003 und ISO 13485:2016
- ISO 13485:2016 und ISO 9001:2015
Besonderheiten im Vergleich zur ISO 9001:2015
Ohne jetzt detailliert alle Unterschiede zur ISO 9001 aufzuzählen und detailliert auf die weitergehenden Normanforderungen der ISO 13485 einzugehen, so sind doch folgende gravierende Unterschiede festzustellen:
- ISO 13485 ist nicht nach der High-Level-Structure aufgebaut
- Es wird weiterhin explizit ein Qualitätsmanagementbeauftragter gefordert, der Mitglied der obersten Leitung sein muss
- Es wird weiterhin in Dokumente und Aufzeichnungen unterschieden
- Es gibt weiterhin Verfahren, die explizit gefordert werden und somit als Pflichtverfahren angesehen werden können
- Der Begriff der Arbeitsumgebung wird weiterhin verwendet und nicht in Prozessumgebung umgewandelt
- Der risikobasierte Ansatz und das Wissen der Organisation haben keinen Weg in die Norm gefunden
- Es wird weiterhin in Korrektur- und Vorbeugungsmaßnahmen unterschieden
Unabhängig von den hier beispielhaft aufgezählten Unterschieden macht die ISO 13485 weitere und weitergehende Forderungen auf, z.B. in folgenden Bereichen:
- Validierung von Prozessen
- Identifizierung und Rückverfolgbarkeit
- Reklamationsbearbeitung
- Berichterstattung an Regulierungsbehörden
- u.v.m.
Brauchen Sie Unterstützung bei der Einführung der ISO 13485 in Ihrem Unternehmen? Sprechen Sie uns gerne einfach an oder schauen sich unsere Dienstleistungen im Bereich ISO 13485 an.
