Filtervalidierung: Der Bakterienrückhaltetest nach ASTM F838-20
Im Rahmen der Filtervalidierung ist der Bakterienrückhaltetest ein Parameter, der gemäß den Anforderungen des PDA 26 Reports und des FDA Guides zu evaluieren ist. Dieser Test, der auch als Bacterial Challenge Test / Assay (BCT / BCA) oder gemäß ISO 13408-2 als "Bakterielle Belastungsprüfung" bezeichnet wird, überprüft die Fähigkeit eines Filters, eine bestimmte Menge Bakterien definierter Größe zurückzuhalten.
Die ASTM F838-20 Methode ist dabei das standardisierte Verfahren zur Durchführung des Bakterienrückhaltetests und ermittelt die bakterielle Rückhalterate des Filters. Dabei wird der Filter in eine vorgegebene Apparatur eingebaut und eine definierte Bakterienlösung durch den Filter gedrückt. Ziel ist es, zu ermitteln, wie viele Log-Stufen an Bakterien der Filter reduzieren kann. Wir haben die wesentlichen Schritte der Testdurchführung für Sie zusammengefasst.
Benötigte Materialien
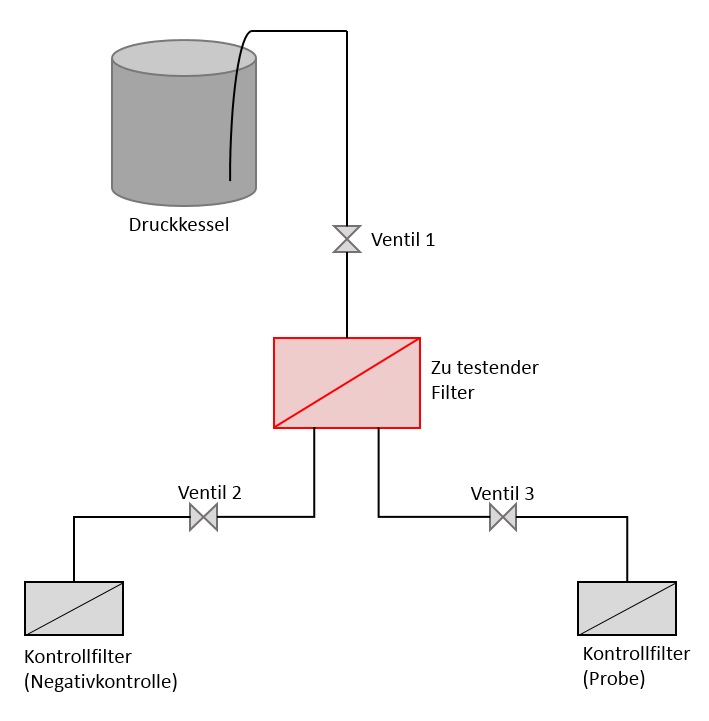
Um den Test durchzuführen, benötigen Sie bestimmte Materialien. In erster Linie ist der Bakterienstamm Brevundimonas diminuta (ATCC 19146) notwendig, da er für die spätere Herstellung der Bakteriensuspension gebraucht wird. Des Weiteren muss die Testapparatur mit Druckanschluss, Druckkessel, den drei Ventilen und dem Testfiltergehäuse zur Verfügung stehen (siehe Abbildung, vereinfachte Darstellung). Außerdem sind Pufferlösungen und Nährmedien (wie z.B. SLB – saline lactose broth – oder TSB – tryptic soy broth) bereitzustellen. Das Labor muss ebenso über eine Sterilwerkbank sowie einen Autoklav und Brutschränke verfügen.
Vorbereitung der Bakteriensuspension
Um die Bakteriensuspension mit einer geeigneten Anzahl an Zellen (je nach Anzuchtverfahren 107 bis 108 bzw. 1-2 x 1010 Zellen/mL) herzustellen, sind mehrere Schritte notwendig. Zunächst muss eine Stammkultur aus der ATCC-Kultur gezüchtet werden. Diese Bakterien werden anschließend in eine Nährlösung und später in eine Puffer-Lösung überführt und jeweils für einen Tag bei 30 ± 2°C bebrütet. Die hergestellte Suspension, die nun für den Test verwendet werden kann, ist maximal acht Stunden im Kühlschrank haltbar. Die Anzucht von B. diminuta gemäß den Vorgaben der ASTM Methode gewährleistet eine Bakteriengröße von 0,3 - 0,4 µm Durchmesser und 0,6 - 1,0 µm Länge. Bakterien dieser Größe werden als sehr klein angesehen und sollen von Sterilfiltern mit einer Porengröße von 0,2 µm zurückgehalten werden.
Ermitteln der Lebendzellkonzentration an Bakterien
Da nur lebende Bakterien später auf dem Kontroll-Filter bzw. -Medium wachsen, ist es wichtig, die Lebendzellzahl der verwendeten Bakterienkultur zu ermitteln. Dabei werden die Zellen zunächst im Mikroskop gezählt. Da hierbei jedoch auch tote Bakterien erfasst werden, ist es notwendig, zusätzlich Bakterienkulturen auf Agar-Platten anzulegen. Hierfür sind verschiedene Verdünnungen (10-3 – 10-5) der Bakteriensuspension anzufertigen und als definierte Menge (0,1 mL) auf den Agar-Platten auszuplattieren. Nach einer Bebrütung der Platten für 48 Stunden sind die gewachsenen Kolonien auszuzählen und anhand derer die Lebendzellkonzentration zu berechnen. Die Konzentration lebender Zellen darf maximal 25% weniger als die Gesamtkonzentration aller Zellen (tote und lebendige) betragen.
Vorbereitung der Apparatur
Für die Durchführung der Testmethode ist die gesamte Apparatur nach den im Folgenden erläuterten festgelegten Vorgaben vorzubereiten. Da der Test mit B. diminuta als vorgegebenem Testkeim durchgeführt wird, ist sicherzustellen, dass die verwendeten Materialien frei von zusätzlichen Verkeimungen sind. Hierfür ist der zu testende Filter in das Filtergehäuse der Apparatur einzubauen und zu sterilisieren (z.B. im Autoklaven). Anschließend ist ein Filterintegritätstest nach Vorgaben des Filterherstellers durchzuführen. Auch die Kontroll-Filter, die später während der Durchführung als „Auffangfilter“ eingesetzt werden, sind zu autoklavieren. Dies betrifft auch alle Schläuche und Verbindungsstücke. Der Druckkessel und das Zufuhrrohr sind mit einem geeigneten Desinfektionsmittel (wie z.B. 70%igem Ethanol) zu behandeln und mit sterilem Wasser zu spülen. Danach ist die Testapparatur unter der sterilen Werkbank zusammenzubauen.
Durchführung der Prüfung
Für die Testdurchführung ist vorab eine Negativkontrolle anzufertigen. Hierfür wird der Druckkessel mit einem ausreichenden Volumen an steriler Puffer- oder Salzlösung gefüllt und der Druck auf 30 psi (= 2,07 bar) erhöht. Anschließend wird nach Öffnen des ersten Ventils der zu testende Filter geflutet und überschüssige Druckluft abgelassen. Durch Öffnen eines weiteren Ventils wird die Lösung auf den Kontroll-Filter weitergeleitet und ein Flussvolumen von 1 L/min eingestellt. Sobald das gesamte Volumen filtriert wurde, wird der Kontroll-Filter unter der sterilen Werkbank auf ein Nährmedium aufgebracht und anschließend für 7 Tage bei 30 ± 2°C bebrütet.
Im Anschluss kann die eigentliche Prüfung beginnen. Hierfür wird die benötigte Menge an Bakteriensuspension (für eine Konzentration von 107 Bakterien pro cm2 effektive Filtrationsfläche) in den Druckkessel eingebracht und die Testdurchführung wiederholt (jedoch mit einer Flussrate von 2 - 4 x 10-3 L/min pro cm2 effektiver Filtrationsfläche). Im Gegensatz zur Negativkontrolle wird die filtrierte Lösung durch Öffnen eines anderen Ventils in eine zweite Leitung geführt und benetzt den dort befindlichen Kontroll-Filter. Dieser ist ebenso auf einer Agar-Platte zur Anzucht möglicher Bakterien aufzubringen und bis zu 7 Tage zu inkubieren.
Der PDA 26 Report sieht zudem noch eine Positivkontrolle vor. Bei der wird statt des zu testenden Sterilfilters ein Filter mit einer Porengröße von 0,45 µm eingesetzt, der von den Bakterien aufgrund ihrer geringeren Größe penetriert werden sollte.
Auswertung des Tests
Nach der Inkubationszeit sind sowohl die Negativkontrolle als auch die eigentliche Probe auf gewachsene Bakterienkolonien zu überprüfen. Ist auf der Probe Bakterienwachstum zu erkennen, ist zu ermitteln, um welches Bakterium es sich handelt. Dies geschieht mit einer mikroskopisch auszuwertenden Gram-Färbung. Der Testkeim B. diminuta ist ein gram-negatives, kleines, stäbchenförmiges Bakterium, dessen Kolonien leicht gelblich und glänzend aussehen. Entsprechend handelt es sich bei andersfarbigen (z.B. hellroten) Kolonien oder gram-positiven Bakterien um eine Kontamination durch Fremdkeime. Anhand der gefunden Kolonienanzahl lässt sich nun die Bakterienrückhalterate des Filters berechnen. Dabei wird von einer Genauigkeit von ± einer Log-Stufe ausgegangen. Sollten sich andere Bakterienstämme auf dem Nährmedium der Probe befinden, ist der Test als ungültig zu erklären. Gleiches gilt, wenn auf der Negativkontrolle Bakterienkolonien vorhanden sind.
Dokumentation der Ergebnisse
Wie bei pharmazeutischen Testverfahren üblich, ist es essentiell, dass die Testdurchführung sowie das Ergebnis genau dokumentiert werden. Folgende Informationen sollten daher im Testbericht enthalten sein:
- Identifikation des Filters (Filtertyp, Hersteller, Chargennummer, Porengröße etc.)
- Umgebungsbedingungen (Druck, Temperatur, Flussrate etc.)
- Konzentration der verwendeten Bakteriensuspension
- Anzahl der Kolonien auf der Negativkontrolle und der Probe
- Ergebnisse des Filterintegritätstests
- Errechnete Filterleistung (Bakterielle Rückhalterate)
Abschließend lässt sich festhalten, dass die standardisierte Durchführung des Bakterienrückhaltetests (Bacterial Challenge Test) entsprechend der ASTM F838-20 Methode, wie sie im Rahmen von Filtervalidierungen anzuwenden ist, den Erhalt verlässlicher Ergebnisse unabhängig vom durchführenden (Lohn-) Labor gewährleistet.
