Was ist Methodenvalidierung?
Mit der Validierung einer analytischen Methode soll nachgewiesen werden, dass mit der Durchführung dieser Methode zu jedem Zeitpunkt und unabhängig von der ausführenden Person verlässliche und reproduzierbare Ergebnisse erzielt werden. Es wird der Beweis erbracht, dass die Methode für ihren Einsatzzweck geeignet ist.
Wann und wofür?
Eine Methodenvalidierung ist nötig, wenn eine neue Methode nach der Etablierung in die Routine-Messung übergehen soll, sich in der praktischen Durchführung Aspekte geändert haben oder die Methode an einem anderen (räumlich entfernten) Standort angewendet werden soll. Dies ist bei Methodentransfers der Fall. Des Weiteren sind alle Analysemethoden, die in einem pharmazeutischen Labor zur Qualitätskontrolle eingesetzt werden sollen, sowie auch diejenigen, die im Rahmen der Reinigungsvalidierung oder beim Umgebungsmonitoring zum Einsatz kommen sollen, vor ihrer späteren Anwendung zu validieren. Die Forderung nach der Validierung der angewandten analytischen Prüfmethoden ist in Deutschland in der AMWHV § 14 festgelegt und findet sich zudem im EU-GMP-Leitfaden in Kapitel 6 sowie 1.9.
Gemäß des Aide-mémoires AiM 07123101 der ZLG sollte bereits der Musterzug wie auch die Probenaufarbeitung (z.B. Zerkleinerungsprozesse von Feststoffen oder Extraktionsschritte) Bestandteil der analytischen Validierung sein. Da die Probenaufbereitung Teil der analytischen Methode ist, ist dies in meinen Augen absolut selbstverständlich. Hinsichtlich des Musterzugs ist nachvollziehbar, dass dieser repräsentativ sein muss. Meines Erachtens ist dies jedoch kein Aspekt der Methodenvalidierung, wenngleich es ohne Frage gewährleistet sein muss.
Regulatorischer Hintergrund: die einzelnen Validierungsparameter
Damit bei Methodenvalidierungen wesentliche kritische Punkte berücksichtigt werden, gibt es regulatorische Vorgaben und anzuwendende Guidelines. Dazu zählt insbesondere die ICH Q2(R1). Diese Richtlinie „Validation of analytical procedures: text and methodology“, die von der International Conference on Harmonisation herausgegeben wurde, bietet Hilfestellung zur Eingruppierung der verschiedenen Analysemethoden und nennt zu evaluierende Parameter.
Analysemethoden, die in der Qualitätskontrolle angewandt werden, werden ihrem Zweck nach unterteilt in Methoden zur Identifikation, zur Gehaltsbestimmung und zum Nachweis von Verunreinigungen. Entsprechend dieser Einteilung sind unterschiedliche Parameter bei der Methodenvalidierung zu berücksichtigen. Die wesentlichen Parameter sind: Richtigkeit, Präzision (in Form von Wiederhol- und interner Laborpräzision), Spezifität, Nachweis- und Bestimmungsgrenze (limit of detection / limit of quantitation, LOD / LOQ), Linearität, Arbeitsbereich und Robustheit.
Was aber sagen uns diese Parameter? Darüber gibt zusammengefasst die folgende Tabelle einen Überblick:
| Validierungsparameter | Gibt Auskunft über: | Wird ermittelt durch (z.B.): | Angabe / statistische Kenngröße |
| Richtigkeit | Systematische Fehler | Spiking-Experimente | Wiederfindungsrate (Recovery) |
| Wiederholpräzision | Zufällige Fehler innerhalb einer Messserie eines Labors (kurzer Zeitraum) | Direkt nacheinander durchgeführte Wiederholungsmessungen | Mittelwert, Standardabweichung, relative Standardabweichung |
| Vergleichspräzision | Laborinterne zufällige Fehler (durch z.B. vers. Geräte, Analysten etc.) | Messungen an z.B. vers. Tagen | |
| Spezifität | Störfaktoren, Einfluss von Begleitstoffen | Stressung, Placebomessung | n.a. |
| Nachweisgrenze | Geringste messbare Menge | Berechnung aus Signal-zu-Rausch (S/N) Verhältnis oder aus der Kalibrierfunktion | Ermittelte Konzentration an der Grenze |
| Bestimmungsgrenze | Geringste quantifizierbare Menge | ||
| Linearität | Zusammenhang von Messsignal und Konzentration | Untersuchung vers. Verdünnungen | Regressionsgerade, Korrelationskoeffizient, Bestimmtheitsmaß |
| Arbeitsbereich | Bereich zwischen oberer und unterer Grenze in dem die Methode validiert ist | Erfolgreicher Nachweis der Linearität, Richtigkeit und Präzision | n.a. |
| Robustheit | Anfälligkeit für Störparameter, die in der Routine auftreten können | Geringe Variation von Methodenparametern | Relative Differenz zur Normalbedingung |
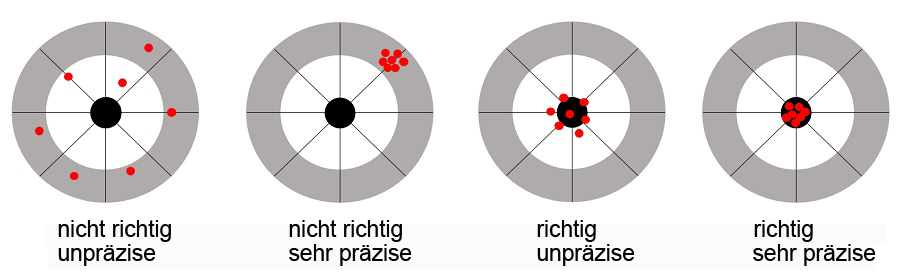
Richtigkeit und Präzision lassen sich am einfachsten über Dartscheiben erklären. Eine Methode kann sehr präzise sein, alle Ergebnisse liegen eng beieinander, befinden aber leider am äußersten Kreis der Dartscheibe. Eine Methode kann eine hohe Richtigkeit aufweisen, alle Ergebnisse zielen ins Schwarze, aber leider ist die Streuung recht groß. Erst wenn eine gute Präzision und eine hohe Richtigkeit gegeben sind, liegen alle Ergebnisse voll im Schwarzen und sind damit dort, wo sie sein sollen. Das Ergebnis ist verlässlich.
Bei Bestimmungen von Verunreinigungen ist es sinnvoll, die Nachweis- und Bestimmungsgrenze zu kennen. Dabei ist die Nachweisgrenze für Limit-Tests / Grenzprüfungen (Übergang von „man sieht nichts / man sieht etwas“) und die Bestimmungsgrenze für quantitative Analysen relevant (Was ist die niedrigste Konzentration, die ich sicher quantitativ erfassen kann?).
Spezifität ist vor allem für Methoden zum Identitätsnachweis unerlässlich. Wenn eine Methode als Identitätsnachweis eingesetzt wird, muss sichergestellt sein, dass sie ausschließlich den nachzuweisenden Analyten in der Probe detektiert und Kreuzreaktionen ausgeschlossen sind. Andernfalls wären falsch positive Ergebnisse die Folge.
Für quantitative Bestimmungen, bei welchen die Konzentration des zu untersuchenden Analyten unbekannt ist und etwas schwanken kann, ist die Linearität der Methode von entscheidender Bedeutung. Eine Methode ist linear, wenn das Messsignal direkt proportional zur Konzentration ist. Mit Hilfe einer Regressionsgeraden lässt sich dann die unbekannte Konzentration des Analyten korrekt berechnen.
Der Arbeitsbereich der Methode lässt sich aus der Linearität, Richtigkeit und Präzision ableiten. Es ist der lineare Bereich zwischen kleinster und größter Konzentration, bei der ein richtiges und präzises Ergebnis erhalten werden kann.
Eine Methode gilt als robust, wenn sie trotz kleiner Abweichungen von der üblichen Durchführung zum gleichen Ergebnis führt. Ein Bespiel aus der Praxis: Bei einer robusten SDS-PAGE bewirkt auch der Einsatz von Fertiggelen unterschiedlicher Hersteller (aber gleicher Konzentration) keinen Unterschied im ermittelten Molekulargewicht des Analyten. Dies sollte statistisch mit einem Äquivalenztest (à Vergleichbarkeit) und nicht z.B. mit einem F-Test (à Unterschiede) geprüft werden.
Praktische Aspekte und zeitlicher Ablauf
Vor Beginn sollte geprüft werden, ob alle Voraussetzungen für den Start der Validierung erfüllt sind. Neben den allgemeinen GMP-Voraussetzungen (wie kalibrierten und qualifizierten Geräten sowie freigegebenen Reagenzien) bedeutet dies, dass die zu validierende Analysenmethode zumindest als Entwurf in einer Arbeits- / Test- oder Prüfanweisung (z.B. in Form einer SOP) beschrieben worden und auch praktisch bereits im Labor gut etabliert ist, die Analysten in der Durchführung geschult sind und ein unterschriebener Validierungsplan vorliegt.
Im Validierungsplan ist das Vorgehen für die geplante Validierung im Detail beschrieben, wobei insbesondere auf die für die Analysenmethode zu untersuchenden Validierungsparameter und die anzuwendenden Akzeptanzkriterien klar und eindeutig (d.h. ohne jeglichen Interpretationsspielraum) eingegangen wird. Des Weiteren wird u.a. das einzusetzende Testmaterial (--> repräsentative Probe(n) und Referenzstandard) festgelegt. Es sollte klar hervorgehen, was, womit, wie, durch wen und bis wann gemacht wird. Ein paar Information zu den Inhalten eines Methodenvalidierungsplans sind in diesem Blogbeitrag gegeben und Beispiel-Vorlagen finden Sie hier.
Nach der Schulung der Analysten im Validierungsplan findet die praktische Durchführung der Experimente statt, deren Dokumentation sind nach den jeweiligen firmeninternen Vorgaben richtet. So kann beispielsweise der Validierungsplan bereits derart gestaltet sein, dass er auszufüllende Anhänge für jeden einzelnen Validierungsparameter beinhaltet. Auf der anderen Seite kann aber auch die generelle Versuchsdokumentation ausgefüllt und die Ergebnisse z.B. in Excel oder Minitab zusammengestellt und ausgewertet werden.
Den Abschluss bildet der zusammenfassende, meist auf Englisch geschriebene, Validierungsbericht mit der Darstellung der einzelnen Ergebnisse, Aussagen inwiefern die anzuwendenden Akzeptanzkriterien der jeweiligen Parameter erfüllt wurden und einem generellen Statement, ob die Validierung erfolgreich war.
Abgrenzung gegenüber Verifizierung und Qualifizierung
Die Methodenvalidierung muss von der Methodenverifizierung und Methodenqualifizierung abgegrenzt werden. Eine Verifizierung wird bei Arzneibuchmethoden eingesetzt, während eine Methodenvalidierung bei selbstentwickelten, sogenannten "In-house"-Analysemethoden angewandt wird. Eine Methodenqualifizierung kommt zwar auch bei In-house-Methoden zum Tragen, jedoch üblicherweise zu einem früheren Zeitpunkt mit leicht anderer Intention. Eine weitere Unterscheidung muss zwischen der hier beschriebenen Methodenvalidierung und der Validierung bioanalytischer Methoden gemacht werden. Details dazu finden sich in diesem Blogbeitrag.
