Was ist ein Validierungsplan und was sagt uns dieser?
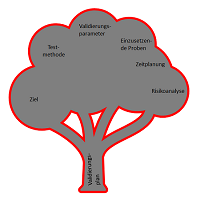
Die Methodenvalidierung ist ein Bestätigungsprozess für die anzuwendenden analytischen Methoden, um ihre Eignung für den beabsichtigten Gebrauch zu bewerten. Validierungsergebnisse werden verwendet, um die Qualität, Zuverlässigkeit und Konsistenz von analytischen Methoden zu beurteilen. Analytische Methodenvalidierung ist daher integraler Bestandteil einer jeder guten analytischen Praxis und eine zwingende Voraussetzung für jede Methode, die in einem pharmazeutischen QC-Labor oder assoziierten Auftragslaboren zur Analyse von Arzneimitteln gemäß GMP-Bedingungen angewandt werden soll.







