Was versteht man unter Qualifizierung?
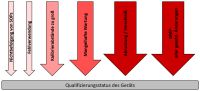
Da für die Durchführung von Analysemethoden in den Laboren der Qualitätskontrolle pharmazeutischer Betriebe oder Lohnlabore Laborgeräte zum Einsatz kommen, müssen diese nachweislich geeignet sein und dürfen z.B. nicht wie im akademischen Umfeld „einfach so“ (d.h. ohne vorherige Überprüfung) verwendet werden. Mit dieser nachweislichen Eignung wollen wir uns heute beschäftigen.
Die Qualifizierung von Laborgeräten (Analytical Instrument Qualification, AIQ) dient dazu, die Eignung des Geräts für den beabsichtigten Gebrauch zu belegen. Sie ist kein einstufiger Prozess, sondern eine Sammlung verschiedener Prozesse, bei der eine Vielzahl von Dokumenten, die sogenannten Qualifizierungsunterlagen, erstellt werden. Je nach Gerät enthält diese Überprüfung neben dem grundsätzlichen Check der Funktion(en) des Gerätes auch z.B. Sicherheitsaspekte für den Bediener. Eine sehr gute Beschreibung findet sich im Kapitel <1058> des amerikanischen Arzneibuchs (United States Pharmacopoeia, USP). Weitere Anforderungen finden sich z.B. auch im Annex 15 des EU GMP-Leitfadens. Die Gerätequalifizierung besteht hauptsächlich aus 4 Schritten: