Was versteht man unter Qualifizierung?
Da für die Durchführung von Analysemethoden in den Laboren der Qualitätskontrolle pharmazeutischer Betriebe oder Lohnlabore Laborgeräte zum Einsatz kommen, müssen diese nachweislich geeignet sein und dürfen z.B. nicht wie im akademischen Umfeld „einfach so“ (d.h. ohne vorherige Überprüfung) verwendet werden. Mit dieser nachweislichen Eignung wollen wir uns heute beschäftigen.
Die Qualifizierung von Laborgeräten (Analytical Instrument Qualification, AIQ) dient dazu, die Eignung des Geräts für den beabsichtigten Gebrauch zu belegen. Sie ist kein einstufiger Prozess, sondern eine Sammlung verschiedener Prozesse, bei der eine Vielzahl von Dokumenten, die sogenannten Qualifizierungsunterlagen, erstellt werden. Je nach Gerät enthält diese Überprüfung neben dem grundsätzlichen Check der Funktion(en) des Gerätes auch z.B. Sicherheitsaspekte für den Bediener. Eine sehr gute Beschreibung findet sich im Kapitel <1058> des amerikanischen Arzneibuchs (United States Pharmacopoeia, USP). Weitere Anforderungen finden sich z.B. auch im Annex 15 des EU GMP-Leitfadens. Die Gerätequalifizierung besteht hauptsächlich aus 4 Schritten:
1. Designqualifizierung (DQ) = "Anforderungsfestlegung"
Die Designqualifizierung (DQ) ist der dokumentierte Nachweis der Aktivitäten, die die funktionalen Spezifikationen des Gerätes sowie die Kriterien für die Auswahl des Herstellers im Hinblick auf den beabsichtigten Einsatzzweck definieren. Sie kann als die Planungsphase angesehen werden, bei der die der Anforderungen für ein bestimmtes Gerät festgelegt werden. Die DQ sollte sowohl vom Gerätehersteller / Anlagenentwickler als auch vom Anwender (also dem eigentlichen Kunden) durchgeführt werden. Der Hersteller muss das Gerät gemäß den im Lastenheft festgelegten Benutzeranforderungen (user requirements specification, URS) entwerfen und herstellen, wenn möglich in einer Umgebung kontrollierter Qualität (soll heißen: also am liebsten unter Einfluss eines Qualitätsmanagementsystems). Der Anwender dagegen kann die Auswahl des Herstellers auf Grundlage der beabsichtigten Verwendung des Geräts und der Übereinstimmung der Anforderungen an den Hersteller mit den von ihm festgelegten Anforderungen im Lastenheft rechtfertigen. Die DQ stellt sicher, dass die Geräte über alle notwendigen Funktionen verfügen, die für den beabsichtigten Zweck verwendet werden sollen. Eine DQ macht Sinn für Großgeräte oder Produktionsanlagen, für ein einfaches Mikroskop könnte es ein bisschen übertrieben sein ;-)
2. Installationsqualifizierung (IQ)
Die Installationsqualifizierung (IQ) ist der dokumentierte Nachweis der Aktivitäten, die erforderlich sind, um zu belegen, dass ein Gerät wie geplant und spezifiziert geliefert wird (durch Vergleich des Lastenheftes mit der Realität), ordnungsgemäß in der gewählten Umgebung installiert wird und dass diese Umgebung auch für das Gerät geeignet ist. Die IQ ermöglicht dem Anwender die ordnungsgemäße Installation des Geräts mit direkter Unterstützung des Herstellers. Die IQ erfordert, dass der Anwender einerseits eine angemessene Arbeitsumgebung einrichtet und aufrechterhält, und ermöglicht ihm andererseits die Identifizierung von möglichen Transportschäden und / oder Abweichungen von der Bestellung. Lassen Sie uns dies anhand eines Beispiels veranschaulichen. Stellen Sie sich ein Labor vor, in dem ein neues Fluoreszenzmikroskop gekauft wurde. Während der IQ wird das Mikroskop an seinem ausgewählten Ort aufgestellt, alle Kabel werden verbunden, die Software wird installiert, alle Dokumente wie z.B. das Benutzerhandbuch werden übergeben und es wird zum ersten Mal eingeschaltet.
3. Funktionsqualifizierung (operational qualification, OQ)
Die Funktionsqualifizierung ist der dokumentierte Nachweis der Aktivitäten, die erforderlich sind, um nachzuweisen, dass ein Gerät im Allgemeinen gemäß seiner anwendungsbezogenen Spezifikation in einer definierten Umgebung funktioniert. Oder einfacher ausgedrückt, beantwortet die OQ die Frage, ob das Gerät in meinem Labor genauso funktioniert, wie ich es erwartet habe. Gemäß der USP "sollten Anwender oder qualifizierte Beauftragte diese Tests durchführen, um zu verifizieren, dass das Gerät die Hersteller- oder Benutzerspezifikationen in der Umgebung des Anwenders erfüllt. Dabei können diese Beauftragten beispielsweise Vertreter des Herstellers sein.". Es ist wichtig, das Gerät in der vom Anwender definierten Umgebung zu testen, da während des Transports und der Installation mechanische Schäden aufgetreten sein können, die die Leistung des Gerätes beeinträchtigen können. Dieser Schritt kann auch eine Erstkalibrierung und / oder eine herstellerseitige Schulung des Personals, welches mit dem neuen Gerät arbeiten wird, umfassen. Bei Geräten, bei denen Messfühler verbaut sind, erfolgt während der OQ auch deren Kalibrierung. Ein Beispiel dafür sind die Temperaturfühler in Brutschränken. ** In unserem Mikroskop-Beispiel wird in der OQ die allgemeine Fähigkeit des Mikroskops, fluoreszierende Färbung zu visualisieren, abgeprüft. Dies kann z.B. durch das Prüfen eines Objektträgers mit fixierten, Cyber green gefärbten Zellen erfolgen. Dies ist ein unspezifischer Test, der noch mit keiner Routinemethode in Verbindung steht.
4. Leistungsqualifizierung (performance qualification, PQ)
Die Leistungsqualifizierung ist die dokumentierte Sammlung der Aktivitäten, die erforderlich sind, um nachzuweisen, dass das Gerät gemäß den vom Benutzer definierten Spezifikationen auch unter Routine-Bedingungen konsistent arbeiten wird und somit für den beabsichtigten Zweck auch wirklich geeignet ist. Obwohl die PQ und die OQ sehr ähnlich erscheinen, gibt es deutliche Unterschiede zwischen den beiden. Eine PQ wird häufiger als eine OQ durchgeführt und unter ähnlichen Bedingungen wie für die spätere Routineanalytik. In unserem Mikroskop-Beispiel wird in der PQ nun ein Routinetest wie der Comet-Assay zum Nachweis von DNA-Schäden, für den in der Vergangenheit mit Silber gefärbte Proben verwendet wurden, durchgeführt und mittels Fluoreszenzfärbung unter Verwendung des neuen Mikroskops analysiert. Kann das neue Mikroskop bei einer Probe mit einem bereits bekannten DNA-Schaden (bereits mit Silberfärbung analysiert) das gleiche quantitative Ergebnis zeigen? Ein anderes Beispiel ist die Aufnahme des Temperaturprofils eines maximal beladenen Autoklavs.
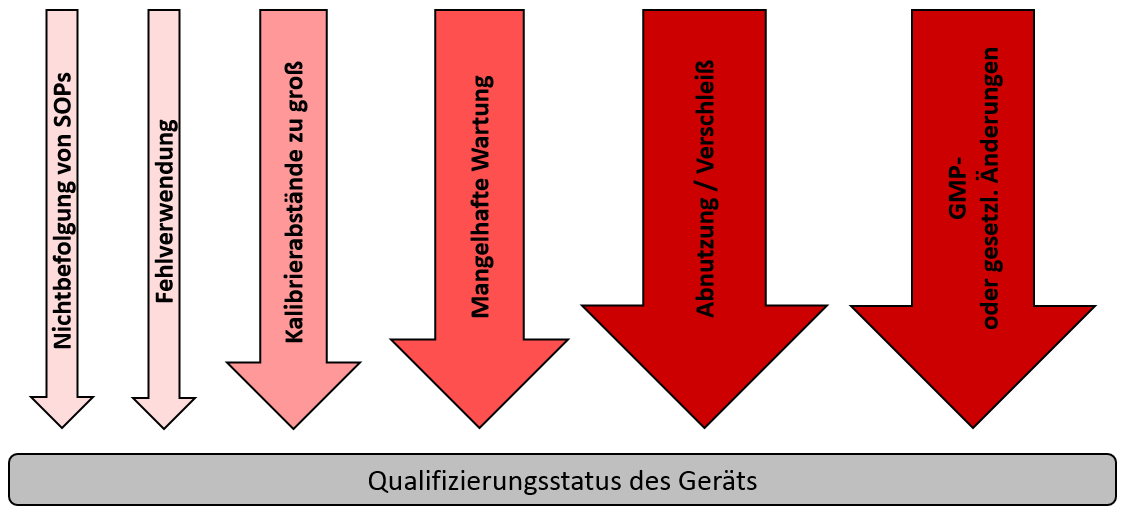
Damit das Laborpersonal auf einen Blick erkennen kann, dass das Laborgerät nach bestandener Erstqualifizierung für die Nutzung freigegeben ist, bietet sich z.B. ein grüner Aufkleber am Gerät zur visuellen Kenntlichmachung an. Daneben sollte ein Gerätelogbuch den Lebenszyklus des Geräts begleiten. Nach einer erfolgreichen Erstqualifizierung werden im Lebenszyklus des Geräts aber auch immer mal wieder Momente auftreten, in denen eine Requalifizierung nötig ist. Einige Einflussfaktoren veranschaulicht die folgende Abbildung.
** Apropos Brutschränke: Kleine Anekdote am Rande: Bitte im Zuge von Transfers sicherstellen, dass auch die Qualifizierung an allen Standorten mit einheitlichen Vorgaben erfolgt und nicht, dass an einem Standort ein Brutschrank mit 37°C ± 1°C qualifiziert wurde, während er an einem anderen Standort 37°C ± 2°C haben darf. Dies mag zwar auf den ersten Blick scheinbar keine Probleme machen, wenn später jedoch eine globale Methode über alle Standorte ausgerollt werden soll und der Standort mit den ± 1°C seine Methode bereits im Zuge der Zulassung eingereicht hat, hat der Standort mit den ± 2°C das Nachsehen und muss ggf. Nachqualifizieren…
